Utilidad del PET-CT en el estadiaje y valoración de respuesta al tratamiento en un segundo tumor primario pulmonar
Fernando Ortega de los Mártires1, María Luisa Chust Vicente2, Leoncio Alfonso Arribas Alpuente2, José Padilla Alarcón3, Miguel Angel Muñoz4, Ana Marhuenda Fluixá5.1 - Unidad PET – Servicio de Medicina Nuclear. Fundación IVO, Valencia, España.2 - Servicio de Oncología Radioterápica. Fundación IVO, Valencia, España.3 - Servicio de Cirugía Torácica. Fundación IVO, Valencia, España.4 - Servicio de Oncología Médica. Fundación IVO, Valencia, España.5 - Servicio de Radiología. Fundación IVO, Valencia, España.
Resumen
Los tumores de cabeza y cuello se asocian con frecuencia a la aparición de segundas neoplasias. La presentación de un segundo tumor en un paciente previamente diagnosticado de un tumor de cabeza y cuello confiere peor pronóstico, por lo que es importante el seguimiento estrecho en pacientes de alto riesgo. El PET-FDG muestra una mayor sensibilidad, especificidad y exactitud diagnóstica que el CT, método habitualmente utilizado para el seguimiento de estos pacientes. Presentamos un caso con diagnóstico previo de carcinoma de orofaringe, el cual presenta durante el seguimiento un segundo tumor primario a nivel pulmonar. Se ilustra cómo un estudio PET-CT sirvió para el diagnóstico y seguimiento post-tratamiento.
Palabras clave: Tumor de cabeza y cuello, segundo tumor primario, PET- CT.
Abstract
Head and neck neoplasms are frequently associated with a second primary tumor. This circumstance results in a worse outcome and survival, and for this reason close follow up is extremely important in high risk patients. PET-FDG scanning has greater specificity, sensitivity and accuracy than CT scan alone, which is used normally in the follow up of these patients. We report a case of a patient initially diagnosed of a squamous cell carcinoma of oropharynx who developed a second lung primary tumor. The value of PET-CT in diagnosis and post-treatment assessment is illustrated.
Key words: Head and neck tumor, second primary tumor, PET-CT.
Introducción
La histología más frecuente en el cáncer de orofaringe es el carcinoma escamoso (94%), el cual también predomina en la vía aerodigestiva superior. Desde un punto de vista oncológico, ésta se divide en: cavidad oral, orofaringe, rinofaringe, hipofaringe y laringe. A su vez, la orofaringe se subdivide en paladar blando, base de lengua, amígdala y pared faríngea.
El carcinoma intraoral y orofaríngeo posee como principales factores de riesgo el alcohol, consumo de tabaco y la infección por el virus del papiloma humano; estos factores pueden actuar por separado o en forma sinérgica(1). Es conocido que los tumores desarrollados en el tracto aerodigestivo presentan una incidencia de aparición de segundos tumores mayor que las neoplasias en otras localizaciones. Este hecho se explicaría, entre otros motivos, por la habitual asociación del consumo de tabaco y alcohol en este tipo de pacientes y la incidencia de estos factores en el desarrollo de varios tipos tumorales. De los segundos tumores primarios, los de pulmón y los de cabeza y cuello son los más frecuentes.
Se denomina tumor primario (TP) al que se diagnostica en primer lugar y el segundo tumor primario (STP) a cualquier otra neoplasia maligna descubierta simultáneamente o con posterioridad. Se denomina STP sincrónico aquel que se diagnostica de forma simultánea o durante los 6 primeros meses siguientes al diagnóstico del TP, y metacrónico al que se diagnóstica después de los 6 meses del TP(2). Presentamos el caso de un paciente que fue tratado quirúrgicamente con un diagnóstico de carcinoma epidermoide de orofaringe. A los tres meses sufre una recidiva local tratada con cirugía y radioterapia. Posteriormente, el paciente desarrolló un STP a los 2 años del TP (STP metacrónico), que resultó un carcinoma indiferenciado de pulmón de células pequeñas (microcítico).
Historia clínica
Se trata de un varón de 59 años con antecedentes de amigdalitis a repetición y fumador de 40 cigarrillos/día desde su juventud, que acude a consulta de ORL por un cuadro de molestias faríngeas inespecíficas y “glositis”. Se detecta por exploración ORL una lesión en pared faríngea y en polo inferior de la amígdala derecha, que llega hasta repliegue faringo-epiglótico. Se interviene quirúgicamente, realizándose una faringectomía parcial con láser + amigdalectomía parcial derecha + vaciamiento funcional cervical derecho modificado que incluye glándula submaxilar derecha.
La anatomía patológica (AP) mostró: Faringe posterior y lateral derecho – carcinoma epidermoide moderadamente diferenciado de 1 cm; polo inferior amigdalino derecho – carcinoma intraepitelial “in situ”; glándula submaxilar derecha negativa para tumor. No adenopatías. Se estadifica como carcinoma epidermoide orofaríngeo T1N0M0, estadio I, decidiéndose seguimiento.
A los 3 meses post-cirugía se detecta una lesión granulomatosa en lecho amigdalino derecho que se extirpa, informando la biopsia un carcinoma intraepitelial “in situ”. Ante la sospecha clínica de recaída se reinterviene, realizándose una amigdalectomía derecha total hasta úvula, incluyendo pilares. La AP reportó carcinoma intraepitelial “in situ” en amígdala derecha, borde inferior de base de lengua, borde interno amigdalino y bordes lateral e inferior de la faringe. La zona próxima a úvula sin evidencia de tumor.
Ante la evidencia de recaída local múltiple por carcinoma “in situ”, se decide dar tratamiento con radioterapia (RT) orofaríngea hasta alcanzar una dosis de 60 Gy. El CT post-RT informa secuelas del tratamiento en sector látero-cervical derecho y orofaringe, así como adenopatías a nivel yugulo-digástrico derecho <1 cm, a controlar evolutivamente. En el seguimiento inmediato, el paciente refiere una leve mucositis pero en general se encuentra muy bien y la exploración ORL es normal. Dos años más tarde y estando el paciente asintomático, se realiza un CT de control donde se observa un nódulo espiculado de 2 cm en el lóbulo pulmonar superior izquierdo y una adenopatía peribronquial izquierda de 2,5 cm. Se realiza broncoscopía que es negativa, no siendo posible la punción aspirativa con aguja fina (PAAF) por el pequeño tamaño de la lesión.
Se indica estudio PET de cuerpo entero y PET-CT torácico para investigar los hallazgos previos. Tanto en el primero (fig. 1) como en el PET-CT torácico (figs. 2, 3 y 4), se detecta acúmulo patológico de la FDG en lóbulo pulmonar superior izquierdo (2 cm, SUVmax=4,2) que se interpreta como un implante nodular maligno. En mediastino se comprueba captación patológica de la FDG en región perihiliar izquierda (2,5 cm, SUVmax=4,1) que corresponde probablemente a una adenopatía mediastínica maligna.
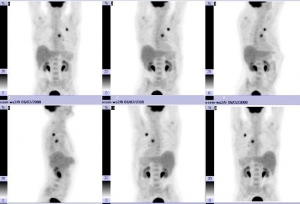
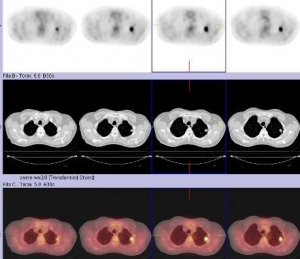
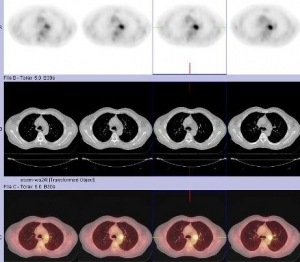
Ante los hallazgos del PET corporal y PET-CT torácico se decide realizar nuevamente con éxito una PAAF pulmonar. La AP informó un carcinoma indiferenciado de pulmón de células pequeñas. Tras el diagnóstico de segundo tumor pulmonar, se decide administrar tratamiento concomitante de RT locoregional y quimioterapia (QT) con Cisplatino y VP6, a un total de 6 ciclos. Recibe tratamiento de RT locoregional sobre el nódulo pulmonar superior izquierdo y ganglios regionales a razón de 2Gy/día, 5 días a la semana hasta un total de 60Gy. Posteriormente y estando el paciente asintomático, se solicita PET corporal y PET-CT torácico de reestadiaje y de valoración de respuesta terapéutica.
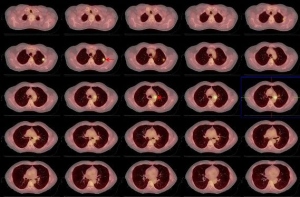
Tanto en el estudio PET corporal (fig. 5) como el PET-CT torácico (fig.6) se detecta la ausencia de hallazgos significativos en lóbulo pulmonar superior izquierdo y en regiones ganglionares hilio-mediastínicas, lo cual refleja una muy buena respuesta al tratamiento concomitante de QT y RT y por tanto remisión completa de la enfermedad.
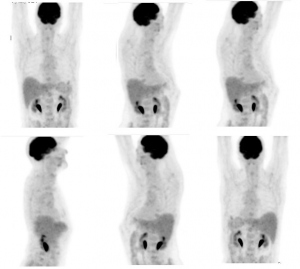
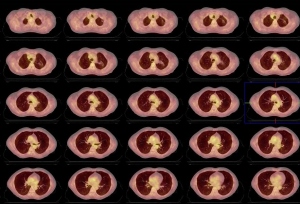
En la evolución hasta el momento actual, el paciente se encuentra asintomático. La exploración ORL detecta fibrosis orofaríngea con mucosa atrófica; faringe, laringe y regiones ganglionares cervicales normales. El CT cervical y torácico ha demostrado cambios secundarios a los tratamientos realizados en orofaringe, región cervical derecha y hemitórax izquierdo.
Discusión
La tasa anual de aparición de STP en pacientes diagnosticados previamente con carcinomas escamosos del tracto aerodigestivo superior es del 6% al 10% de por vida(3), variando su incidencia global según las series entre 7% y 20%. La aparición de un STP está relacionada con una disminución en la superviviencia, ya que es la causa más frecuente de muerte en pacientes en estadios iniciales de cabeza y cuello, aunque su pronóstico es mejor que el de los pacientes que desarrollan metástasis o recidivas. Por tal motivo es muy importante el seguimiento, la duración del mismo y los métodos diagnósticos utlizados.
Existen varios modelos para explicar la aparición de STP. Uno de ellos es el llamado “campo de cancerización”, según el cual existen múltiples lesiones precancerosas, no relacionadas, adyacentes al tumor primario que pueden desarrollar cada una de ellas un nuevo tumor condicionadas por la exposición durante largo tiempo a los carcinógenos del tabaco y alcohol(4).
Recientemente se han descrito modelos biológicos como el de la expansión clonal, en el que el STP se presenta con las mismas características genéticas que el TP sugiriendo el origen del mismo clon, o el de la red de ‘stem cells’. Esta se define como un conjunto de stem cells somáticas funcionalmente relacionadas, cuyo papel es asegurar la homeostasis y la reparación del tejido de una región anatómica, con un perfil anátomo-molecular específico y manteniendo un alto grado de sincronización del ciclo celular. Este modelo implica también la movilidad de stem cells que pueden migrar de un nicho a otro de la red, creando así un campo de cancerización(5).
Los STP más comunes son los de pulmón, cabeza y cuello y esófago(6); su aparición es más frecuente a partir del tercer año después del tratamiento del primario. Los segundos tumores asociados a carcinoma escamoso de orofaringe han disminuido debido al aumento de los carcinomas orofaríngeos relacionados con HPV (virus del papiloma humano)(7); estos generalmente aparecen en pacientes no fumadores y tienen menos mutaciones y alteraciones cromosómicas que los tumores HPV negativos.
Peck(8) reporta una incidencia de STP a 5 años en pacientes con tumores de orofaringe HPV negativos del 14,6% mientras que en los HPV positivos es del 5,6%. Esta incidencia se puede modificar a su vez por el estatus de fumador siendo el riesgo de pacientes HPV positivos fumadores de 10.5%, y del 0% en pacientes HPV positivos no fumadores. La condición de fumador no solo cambia la incidencia sino la localización de segundos tumores; mientras que en pacientes HPV negativos la localización de STP es similar a la del resto de tumores de cabeza y cuello, tradicionalmente asociadas al uso del tabaco (pulmón, cabeza y cuello, esófago, vejiga), en los HPV positivos la aparición de STP es menor y en localizaciones distintas a las tradicionales(8) lo cual podría tener implicaciones en los métodos diagnósticos usados durante el seguimiento.
Generalmente, la técnica más utilizada en la estadificación de los tumores de cabeza y cuello es el CT torácico; sin embargo, este método diagnóstico tiene una sensibilidad y especificidad del 73% y 80% respectivamente(9). A nivel abdominal, el CT muestra hallazgos casi siempre inespecíficos, siendo de utilidad cuestionable.
En los últimos años ha ido aumentando el uso del PET-FDG para la detección de segundos tumores o metástasis en pacientes diagnosticados de tumores de cabeza y cuello de alto riesgo, por su capacidad de dar información sobre lesiones metabólicamente activas. En un meta-análisis realizado sobre la utilidad del PET-CT para la detección de STP en cabeza y cuello, se concluye que el método tiene una sensibilidad del 88% y una especificidad del 95%, indicando una alta seguridad diagnóstica y por tanto debería ser usada como técnica de elección para la investigación de STP o metástasis(10).
Más recientemente, se ha desarrollado la resonancia magnética que permite hacer un estudio de cuerpo completo en un sola sesión con una sensibilidad (77%-95%), especificidad (98%-99%) y capacidad diagnóstica (90%-97%) muy adecuadas en la detección de metástasis o segundos tumores y similar al PET-FDG(11, 12).
En el caso presentado en este trabajo se trata de un paciente fumador, diagnosticado con carcinoma de orofaringe, del que no conocemos si es HPV positivo. A los cinco meses del diagnóstico inicial presenta una recidiva local múltiple por carcinoma in situ. Esta presentación podría cumplir los criterios de la teoría del campo de cancerización dado el desarrollo de varias lesiones en la mucosa adyacente a la localización del TP. Aunque desconocemos el status de HPV, la condición de fumador hace que el riesgo de aparición de un STP y de que éste aparezca en localizaciones típicas relacionadas con el consumo de tabaco sea mayor, lo cual podría ayudar a seleccionar qué pruebas diagnósticas se deben utilizar durante el seguimiento.
Debido al cambio en el pronóstico que conlleva la aparición de un STP, se debería seleccionar pacientes de alto riesgo para un seguimiento estrecho con pruebas de alta precisión diagnóstica. Idealmente, la identificación temprana de estos pacientes se podría realizar mediante la detección de polimorfismos de genes implicados en la carcinogénesis del carcinoma escamoso de cabeza y cuello, como el p53 y el p21(13,14).
Referencias
- Guzman P, Villaseca M, Antonio L, et al. Carcinoma epidermoide oral y orofaríngeo. Estudio Clínico patológico. Rev Chil Cir 2011;63:250-6.
- López C, Estelles E, Carrasco M, et al. Neoplasias malignas múltiples en el cáncer escamoso de cabeza y cuello. Acta Otorrinolaringol Esp 2008;59:427-32.
- Choi M, Craft B, Geraci SA. Surveillance and monitoring of adult cancer survivors. Am J Med 2011;124:598-601.
- Slaughter DP, Southwick HW, Smejkal W. Field cancerization in oral stratified sqamous cell epithelium; clinical implications of multicentric origin. Cancer 1953;6:963-8.
- Cabanillas R, LLorente JL. The stem cell network model: clinical implications in cancer. Eur Arch Otorhinolaryngol 2009;266:161-70.
- Morris LG, Sikora AG, Hayes RB, et al. Anatomic sites at elevated risk of second primary cancer after an index head and neck cancer. Canc Causes Contr 2011; 22: 671-679.
- Morris LG, Sikora AG, Patel SG, et al. Second primary cancers after an index head and neck cancer: subsites-speficic trends in the era of human papillomavirus associated oropharyngeal cancer. J Clin Oncol 2011;29:739-46.
- Peck BW, Dahlstrom KR, Gan SJ. Low risk of second primary malignancies among never smokers with human papillomavirus-associated index oropharyngeal cancers. Head Neck 2012; Jun 19 (Epub ahead of print).
- Brouwer J, de Bree R, Hoekstra OS, et al. Screening for distant metastases in patients with head and neck cancer: is chest computed tomography sufficient? Laryngoscope 2005;115:1813-7.
- Xu GZ, Guan DJ, He ZY.18FDG-PET/CT for detecting distant metastases and second primary cancers in patients with head and neck cancer. A meta-analysis. Oral Oncol 2011;47:560-5.
- Ng SH, Chan SC, Yen TC, et al. Pretreatment evaluation of distant-site status with nasopharyngeal carcinoma: accuracy of whole body MRI at 3-tesla and FDG-PET-CT. Eur Radiol 2009;19:1366-78.
- Ng SH, Chan SC, Yen TC, et al. Comprehensive imaging of residual/ recurrent nasopharyngeal carcinoma using whole-body MRI at 8 T compared with FDG-PET-CT. Eur Radiol 2010;20: 2229-40.
- Li F, Sturgis EM, Chen X, et al. Association of p53 codon 72 polymorphism with risk of second primary malignancy in patients with squamous cell carcinoma of the head and neck. Cancer 2010;16:2350-9.
- Lei D, Sturgis EM, Liu Z, et al. Genetic polymorphisms of p21 and risk of second primary malignancy in patients with index squamous cell carcinoma of the head and neck. Carcinogenesis 2010;31:222-7.
