Linfoma adrenal bilateral: Aporte de la imagen multimodal
Mónica Vidal González1, Catalina Posada Cuartas2, Alejandro Delgado Quijano1, Juan Esteban López Amaya3, Kenny Mauricio Galves Cardenas4.1 - Departamento de Medicina Nuclear, Hospital Pablo Tobón Uribe. Medellín, Colombia..2 - Departamento de Radiología, Universidad CES. Medellín, Colombia..3 - Departamento de Hematología, Hospital Pablo Tobón Uribe. Medellín, Colombia..4 - Departamento de Radiología, Hospital Pablo Tobón Uribe. Medellín, Colombia..
Introducción
El linfoma adrenal es una patología rara, que puede ser secundaria en el 25% de los linfomas no Hodgkin (LNH) y primaria en el 1%(1). Es bilateral en el 75% de los casos y usualmente cursa sin enfermedad metastásica al momento del diagnóstico (2,3). Los síntomas clínicos más frecuentes son constitucionales, tales como: fiebre, diaforesis nocturna, pérdida de peso, dolor y fatiga; en aproximadamente el 50% de los casos se asocia con síntomas de insuficiencia adrenal. Predomina en el sexo masculino y la edad promedio de presentación es de 62 años ref{4,5}. El diagnóstico definitivo es histopatológico, pero al requerir un procedimiento invasivo está asociado a complicaciones y mayor morbilidad. No obstante, las modalidades de imagen como la tomografía por emisión de positrones con 18-fluoro-2-desoxiglucosa (18F-FDG PET/TC), la tomografía computarizada (TC) y la resonancia magnética (RM) han demostrado ser útiles en la diferenciación entre masas adrenales benignas y malignas, permitiendo diagnosticar, estadificar, monitorizar la respuesta al tratamiento y detectar recurrencias(6,7,8).
Descripción del caso
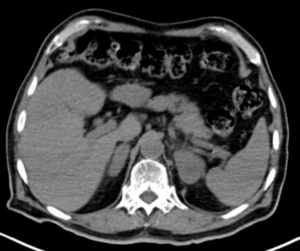
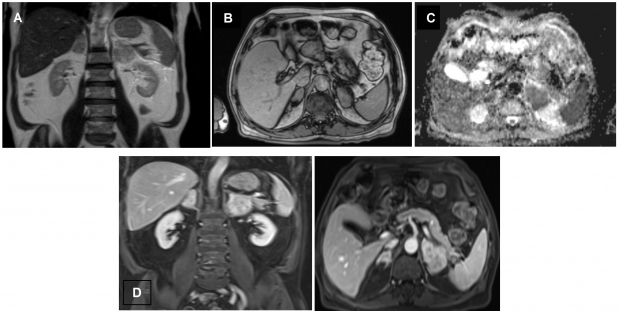
Hombre de 69 años, con antecedentes de diabetes mellitus tipo 2, EPOC, hipertensión arterial y dislipidemia, quien presentó cuadro clínico de un mes de evolución consistente en pérdida de 7 kg de peso, disminución de la clase funcional, dolor abdominal, episodios eméticos y deposiciones diarreicas sin moco ni sangre. Se documentó hiponatremia, hipercalcemia, insuficiencia adrenal primaria (cortisol 5,8 µg/dL, ACTH 646,4 pg/mL) y anemia normocítica normocrómica. Se realizó TC tóracoabdominal simple, evidenciando masas adrenales bilaterales sólidas, de densidad homogénea con atenuación de 29 UH, sin calcificaciones (fig. 1). Para mejor caracterización de las lesiones adrenales se realizó RM abdómino-pélvica, mostrando en las secuencias T2 una señal alta, en las T1 supresión grasa pre-contraste con una señal baja y homogénea. Con el medio de contraste se observó realce progresivo, con áreas de restricción a la difusión en las secuencias de difusión y mapa ADC. No se comprobó enfermedad metastásica ni invasión de estructuras adyacentes (fig. 2).
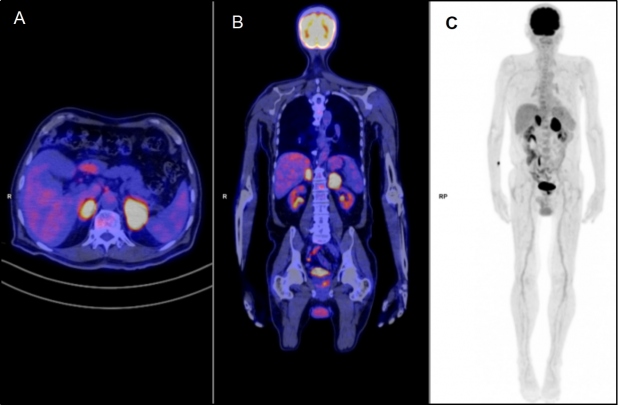
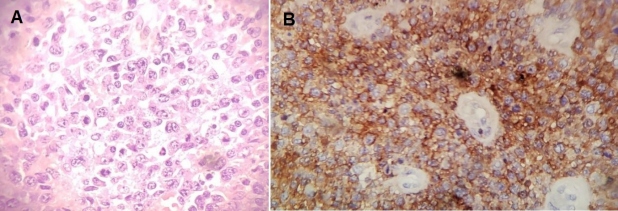
Con el fin de estadificar y caracterizar el comportamiento metabólico de las lesiones descritas en las glándulas suprarrenales, se realizó un estudio 18F-FDG PET/TC que mostró masas adrenales sólidas bilaterales con intenso aumento del metabolismo, sin evidencia de compromiso nodal o extranodal local ni a distancia, compatible con viabilidad tumoral mal diferenciada primaria adrenal bilateral (fig. 3). Dada la ubicación de las masas y sus características por imagen multimodal, se sugirió un diagnóstico de síndrome linfoproliferativo y por decisión multidisciplinaria se realizó adrenalectomía izquierda, cuyo análisis histopatológico e inmunohistoquímico fue compatible con LNH primario adrenal tipo B difuso de células grandes, patrón no-centro germinal (fig. 4).
Discusión
La elevada tasa actual de detección de tumores adrenales (4-10% de la población general) se atribuye al uso generalizado de estudios de imagen(9). La mayoría de los hallazgos representan incidentalomas clínicamente silenciosos y biológicamente indolentes, pero algunos tumores suprarrenales pueden plantear un desafío clínico importante. Dentro de los diagnósticos diferenciales de las masas adrenales bilaterales, se incluyen: metástasis, linfoma, enfermedad granulomatosa, hiperplasia, hemorragia, adenoma y feocromocitoma(10,11,12).
En este reporte de caso ilustramos los hallazgos en un paciente con masas adrenales bilaterales, cuyo diagnóstico definitivo fue LNH B difuso de células grandes, el cual representa el tipo histológico más común del linfoma adrenal primario y suele tener una baja incidencia de compromiso extra-adrenal(13). Para que haya alteración de la función adrenal debe existir destrucción de más del 90% del tejido glandular; sin embargo, en los linfomas primarios esta alteración se ha visto hasta en el 61% de los casos, debido al diagnóstico tardío por la ausencia de síntomas en etapas tempranas de la enfermedad(5,12).
Las imágenes juegan un papel fundamental en la caracterización de las lesiones adrenales; desde su diagnóstico, para guiar la toma de biopsia, en el planeamiento quirúrgico, en la estadificación local y a distancia, en la evaluación de la respuesta a la terapia y ante la sospecha de recaída tumoral(7). La TC es la modalidad de elección para la valoración anatómica inicial de las masas adrenales; el valor de atenuación, la captación de contraste y el porcentaje de lavado en fase tardía son útiles para diferenciar lesiones benignas de malignas, con una sensibilidad del 98% y especificidad del 92%(14,15,16). Si la atenuación de la glándula adrenal es superior a 10 UH, se debe realizar una TC contrastada y calcular el porcentaje de lavado en la fase tardía; más del 60% del lavado de contraste absoluto y 40% del relativo en una TC en fase tardía, es característico de un adenoma rico en lípidos. En nuestro paciente se visualizaron lesiones con atenuación homogénea, sin calcificaciones ni degeneración quística, con atenuación > 10 UH, lo cual hace menos probable el diagnóstico diferencial con adenomas o feocromocitomas(17,18,19).
La RM posee mejor resolución para la evaluación de tejidos blandos; las características de la intensidad de señal varían dependiendo de la secuencia y su vascularidad. En las secuencias de T1, estos tumores presentan señal de intensidad baja y en las de T2 señal de alta intensidad heterogénea, con realce progresivo y ávido en las secuencias dinámicas post-contraste(20,21). En las secuencias en fase y fuera de fase con desplazamiento químico, no presentan caída de señal, indicando ausencia de grasa intracitoplasmática. Adicionalmente, por el aumento de la densidad celular y la relación núcleo/citoplasma alterada, los tumores - incluyendo el linfoma - presentan restricción a la difusión(22,23,24). Se ha descrito una sensibilidad del 94% y una especificidad del 95 % para la distinción de lesiones adrenales benignas de malignas con RM(17). En el caso del paciente reportado, presentaba las características mencionadas, resaltando las áreas con importante restricción a la difusión, incrementando la sospecha diagnóstica diferencial entre linfoma o metástasis (fig. 2).
La fluorodesoxiglucosa (FDG) es un análogo de la glucosa ampliamente utilizado para identificar neoplasias malignas con aumento anormal del metabolismo anaeróbico de la glucosa (efecto Warburg), jugando un papel importante en la diferenciación entre masas adrenales benignas y malignas, con una sensibilidad y especificidad del 91%, así como en la determinación de la extensión tumoral y la presencia de metástasis, monitorización de la respuesta al tratamiento y detección de recurrencia(6,7,25,26). La 18F-FDG PET/TC ha demostrado una alta precisión diagnóstica en la caracterización de las lesiones adrenales, cuyo análisis cualitativo se interpreta como positivo para malignidad sí la captación es mayor o igual a la del hígado y como negativo si es menor. En el análisis semicuantitativo mediante el valor de captación máxima estandarizada (SUVmax), se establece un umbral de 3,1 para diferenciar las lesiones malignas de las benignas(6,10). El uso concomitante de los umbrales de la TC disminuye la tasa de falsos positivos(9,11); algunos estudios demuestran que la tasa total de glicólisis (TLG) - un parámetro metabolo-volumétrico cuantitativo del PET/CT - es útil en pacientes con incidentaloma adrenal de riesgo intermedio a alto, mientras que una TLG superior a 12 sería el indicador de malignidad con mayor precisión diagnóstica(27,28).
Los linfomas adrenales primarios tienen una alta avidez por la FDG y generalmente no presentan compromiso extra-adrenal(1,2). En nuestro caso, las masas adrenales bilaterales con intenso aumento del metabolismo en ausencia de compromiso nodal y a distancia, sugieren como primera posibilidad el diagnóstico de linfoma primario.
El colegio americano de radiología (ACR) propone un algoritmo para el manejo de incidentalomas adrenales >1 cm por TC o RM, en el cual las imágenes con características tales como: calcificaciones, mielolipomas, quistes o adenomas con atenuación <10 UH o caída de señal en secuencias fuera de fase, se consideran benignas y no requieren seguimiento. En lesiones indeterminadas, si miden > 4 cm con historial de cáncer o entre 1-4 cm y han aumentado de tamaño respecto a estudios previos, o si el lavado del medio de contraste es < 60-40%, se debe considerar 18F-FDG PET/TC(25).
Posterior a la confirmación del diagnóstico histopatológico definitivo, el paciente fue remitido para manejo por parte del servicio de hemato-oncología. El tratamiento actual es similar al de otros linfomas, incluyendo quimio-inmunoterapia con o sin radioterapia. El pronóstico y la remisión completa posterior al tratamiento dependen de la presencia de enfermedad avanzada y/o de factores pronósticos adversos al momento del diagnóstico. La tasa de supervivencia global para los pacientes con linfoma adrenal primario es mayor al 19% a los 5 años y se reduce a menos del 4% a los 10 años(1,2,3). Sin embargo, con los avances terapéuticos y las nuevas técnicas de imagen, la sobrevida en esta enfermedad ha ido aumentando.
Este caso es muy representativo e ilustra los principales hallazgos con las diferentes modalidades diagnósticas como TC, RM y 18F-FDG PET/TC, tales como el realce arterial, la restricción a la difusión y el aumento anormal del metabolismo respectivamente, herramientas que facilitan el diagnóstico, estadiaje y evaluación de respuesta al tratamiento. La evaluación multimodal es útil en el contexto de un paciente con lesiones adrenales, aportando elementos diferentes y complementarios para aproximarnos al diagnóstico definitivo.
Referencias
- McDonnell T, Mulkerrin E. Primary adrenal lymphoma. N Engl J Med 2021;384:165.
- Raoofziaee M, Yarmohamadi A, Ahmadnia H. Primary bilateral non-Hodgkin’s lymphoma of the adrenal gland. Indian J Urol 2018;34:300-2.
- Rashidi A, Fisher SI. Primary adrenal lymphoma: a systematic review. Ann Hematol 2013;92:1583-93.
- Horiguchi K, Hashimoto K, Hashizume M, et al. Primary bilateral adrenal diffuse large B-cell lymphoma demonstrating adrenal failure. Intern Med 2010;49:2241-6.
- Mozos A, Ye H, Chuang WY, et al. Most primary adrenal lymphomas are diffuse large B-cell lymphomas with non-germinal center B-cell phenotype, BCL6 gene rearrangement and poor prognosis. Mod Pathol 2009;22:1210-7.
- Kim SJ, Lee SW, Pak K, et al. Diagnostic accuracy of 18F-FDG PET or PET/CT for the characterization of adrenal masses: a systematic review and meta-analysis. Br J Radiol 2018;91:20170520
- Barat M, Cottereau AS, Gaujoux S, et al. Adrenal mass characterization in the era of quantitative imaging: State of the art. Cancers (Basel) 2022;14:569
- Karaosmanoglu AD, Onder O, Leblebici CB, et al. Cross-sectional imaging features of unusual adrenal lesions: a radiopathological correlation. Abdom Radiol 2021;46:3974-94.
- Yu K, Xue Q, Zhou F, et al. A novel diagnostic model for primary adrenal lymphoma. Front Endocrinol 2021;12:636-58.
- Evangelista L, Crimì F, Visentin A, et al. [18F]FDG PET/CT and PET/MR in patients with adrenal lymphoma: A systematic review of literature and a collection of cases. Curr Oncol 2022;29:7887-99.
- Elsayes KM, Emad-Eldin S, Morani AC, Jensen CT. Practical approach to adrenal imaging. Urol Clin North Am 2018;45:365-87.
- Elsayes KM, Mukundan G, Narra VR, et al. Adrenal masses: MR imaging features with pathologic correlation. RadioGraphics 2004;24(suppl-1):S73-86.
- Wang Y, Ren Y, Ma L, et al. Clinical features of 50 patients with primary adrenal lymphoma. Front Endocrinol 2020;11:595.
- Caoili EM, Korobkin M, Francis IR, et al. Adrenal Masses: Characterization with combined unenhanced and delayed enhanced CT. Radiology 2002;222:629-33.
- Blake MA, Cronin CG, Boland GW. Adrenal imaging. Am J Roentgenol 2010;194:1450-60.
- Park BK, Kim CK, Kim B, Lee JH. Comparison of delayed enhanced CT and chemical shift MR for evaluating hyperattenuating incidental adrenal masses. Radiology 2007;243:760-5.
- Mayo-Smith WW, Boland GW, Noto RB, Lee MJ. State-of-the-art adrenal imaging. RadioGraphics 2001;21:995-1012.
- Nandra G, Duxbury O, Patel P, et al. Technical and interpretive pitfalls in adrenal imaging. RadioGraphics 2020;40:1041-60.
- Mclean K, Lilienfeld H, Caracciolo JT, el al. Management of isolated adrenal lesions in cancer patients. Cancer Control 2011;18:113-26.
- Fujiyoshi F, Nakajo M, Fukukura Y, Tsuchimochi S. Characterization of adrenal tumors by chemical shift fast low-angle shot MR imaging: Comparison of four methods of quantitative evaluation. Am J Roentgenol 2003;180:1649-57.
- Miller FH, Wang Y, McCarthy RJ, et al. Utility of diffusion-weighted MRI in characterization of adrenal lesions. Am J Roentgenol 2010;194:W179-85.
- Haider MA, Ghai S, Jhaveri K, Lockwood G. Chemical shift MR imaging of hyperattenuating (>10 HU) adrenal masses: Does it still have a role? Radiology 2004;231:711-6.
- Sandrasegaran K, Patel AA, Ramaswamy R, et al. Characterization of adrenal masses with diffusion-weighted imaging. Am J Roentgenol 2011;197:132-8.
- Morani AC. Abdominal applications of diffusion-weighted magnetic resonance imaging: Where do we stand. World J Radiol 2013;5:68-80.
- Navin PJ, Moynagh MR. Optimal and novel imaging of the adrenal glands. Curr Opin Endocrinol Diabetes Obes 2022;29:253-62.
- Dong A, Cui Y, Wang Y, et al. (18)F-FDG PET/CT of adrenal lesions. Am J Roentgenol 2014;203:245-52.
- Kim YI, Cheon GJ, Paeng JC, et al. Total lesion glycolysis as the best 18F-FDG PET/CT parameter in differentiating intermediate-high risk adrenal incidentaloma. Nucl Med Commun 2014;35:606-12.
- Ciftci E, Turgut B, Cakmakcilar A, Erturk SA. Diagnostic importance of 18F-FDG PET/CT parameters and total lesion glycolysis in differentiating between benign and malignant adrenal lesions. Nucl Med Commun 2017;38:788-94.
